カルボニル化蛋白測定キット
(ヒト/動物用)
Carbonyl Protein ELISA |
|
| (酸化ストレス研究用試薬) |
|
| 【タンパク質の酸化損傷生成物】 |
 |
酸化ストレスの亢進は、タンパク質にもフラグメント化、アミン酸化など様々な形で酸化損傷を与えます。
中でもタンパク質のカルボニル化修飾は、よく研究されている酸化損傷生成物の一つであり、酸化損傷の鋭敏なバイオマーカーの一つとされて
います。糖尿病患者(IDDM)において血漿中のカルボニル化蛋白レベルが上昇するほか、老化に伴い組織中のカルボニル化蛋白が増加すること、
高齢者女性において血清中のカルボニル化蛋白レベルが死亡リスクに関連することが報告されています。
カルボニル化タンパク質の測定には、従来からジニトロフェニルヒドラジン(dinitrophenylhydrazine: DNPH)との反応を利用した比色法や
HPLC法が用いられてきましたが、必要なサンプル量が多いなどの問題がありました。本キットはサンプル中に含まれるカルボニル化タンパク質を
DNPHと反応させた後、DNPHが結合したタンパク質に特異的な抗体を用いることで、高感度にカルボニル化タンパク質を測定することができます。
|
|
 |
| 【製品仕様】 |
| ● 測定対象: |
ヒトおよび動物由来の血漿、肺胞洗浄液、脳脊髄液、細胞抽出液など(ウサギ由来検体除く) |
| ● 測定レンジ: |
156 - 2500 pmol/mg protein |
| ● 所要時間: |
前処理に約2時間、および ELISA測定に約4時間(または一晩 + 1時間) |
| ● サンプル所要量: |
約4μL |
| ● テスト数: |
96 wells |
| ● 必要な器具: |
マイクロプレートリーダー(測定波長450nm)、8チャンネルマイクロピペット(50〜250μL)、
マイクロピペット(0.5〜1000μL用)、エッペンドルフチューブ(1.5mL)、蒸留水、遠心機、ボルテックスミキサー、
限外濾過フィルター(商品コード:KPC-FLT)、タンパク濃度測定キット(商品コード:KPC-BCAなど)
|
| ● 保存条件: |
冷蔵(2〜8℃ ・凍結不可) |
|
 |
| 品名 |
商品コード |
仕様 |
価格(税込) |
| カルボニル化蛋白測定キット(ヒト/動物用) |
KPC-250D |
96wells |
82,500円 |
| 【オプション】KPC-250D専用限外濾過フィルター |
KPC-FLT |
100個入り |
77,000円 |
| 【オプション】KPC-250D専用タンパク濃度測定キット |
KPC-BCA |
96wells |
19,800円 |
ヒトカルボニル化蛋白測定キット
(ヒト血清/血漿用:単位 U/mL 蛋白濃度の測定は不要) |
KPC-870D |
96wells |
82,500円 |
カルボニル化蛋白測定キット
(オタゴ大学Winterbourn教授らが開発) |
KPC-010BT |
96wells |
82,500円 |
| カルボニル化蛋白受託検査 |
測定原理:ELISA法(KPC-250D)
最少検体数(ヒト/動物):10
検体提出量:1mL(最少0.2mL) |
13,530円 |
測定原理:ELISA法(KPC-870D)
最少検体数(ヒト):10
検体提出量:1mL(最少0.2mL) |
9,350円 |
|
【製造元】:Immundiagnostik AG, Germany
|
| 【ご注意】本製品は研究用試薬です。研究以外の用途(臨床検査/診断/医療行為等)には使用できません。 |
日研ザイル株式会社 日本老化制御研究所 〒437-0122 静岡県袋井市春岡710-1 TEL 0538-49-0125 FAX 0538-49-1267
Copyright© 2011 JaICA All Rights Reserved.
| 【製品構成】 |
| 1. |
マイクロプレート |
1枚(96 wells) |
| 2. |
洗浄液(x10濃縮) |
100mL 蒸留水にて10倍希釈して使用します。結晶が析出している場合、37℃に加温して溶解します。 |
| 3. |
スタンダード(STD) |
50μL |
| 4. |
コントロール(CTRL) |
50μL |
| 5. |
コンジュゲート(CONJ) |
22 mL |
| 6. |
1次抗体(AB) |
240μL 使用直前に、1次抗体希釈液にて101倍希釈します(希釈液22mLに対し220μLを混合します)。 |
| 7. |
1次抗体希釈液(ABBUF) |
30 mL そのまま使用します。 |
| 8. |
DNPH試薬(DER) |
9 mL そのまま使用します。飽和濃度で調製されているため、結晶が沈殿しています。 |
| 9. |
アッセイバッファー(ASYBUF) |
100 mL x 2本 そのまま使用します。 |
| 10. |
TMB試薬(SUB) |
15 mL そのまま使用します。 |
| 11. |
反応停止液(STOP) |
15 mL そのまま使用します。 |
| ※ |
カルボニル化蛋白の定量は、タンパク質1mg当たりのモル数で算出します。
このため、サンプル中のタンパク濃度を別途測定する必要があります。BCA法など、安価なタンパク定量キットが
市販されておりますので、ご利用ください。 |
|
| 【ELISA測定操作】 |
| 1. |
分割式マイクロプレートのうち、使用する数だけ取り出します。残りは袋に戻して密閉、冷蔵保存します。 |
| 2. |
誘導体化処理、希釈したサンプル、スタンダード及びコントロールを 200μL/ウェル分注します。
N=2での測定を推奨します。 |
| 3. |
プレートをしっかりシールして、37℃にて3時間、または2〜8℃にて一晩反応させます。 |
| 4. |
ウェル内の液を捨て、希釈済み洗浄液 250μLにて5回洗浄、
最後にペーパータオルに叩き付けて液をよく切ります。 |
| 5. |
全てのウェルに、希釈済み1次抗体試薬を 200μL/ウェル分注、しっかりシールして室温にて20分間静置します。
※振とうしないよう、注意してください※ |
| 6. |
ウェル内の液を捨て、希釈済み洗浄液 250μLにて5回洗浄、
最後にペーパータオルに叩き付けて液をよく切ります。 |
| 7. |
全てのウェルに、コンジュゲート試薬(CONJ)を 200μL/ウェル分注、しっかりシールして室温にて20分間静置します。
※振とうしないよう、注意してください※ |
| 8. |
ウェル内の液を捨て、希釈済み洗浄液 250μLにて5回洗浄、
最後にペーパータオルに叩き付けて液をよく切ります。 |
| 9. |
全てのウェルに、TMB試薬(SUB)を 200μL/ウェル分注、室温暗所にて15〜20分間静置します。
※光が当たると、バックグラウンドが上昇します。必ずアルミホイル等で遮光してください※ |
| 10. |
全てのウェルに、反応停止液(STOP)を 50μL/ウェル分注、軽く振とうします。 |
| 11. |
直ちに450nmにおける吸光度を測定します。副波長には620nmまたは690nmが適しています。
吸光度が高すぎる場合には、測定波長405nm、副波長620nmとして測定してください。 |
| 12. |
検量線をひき、サンプル中のカルボニル化蛋白量(pmol/mg protein)を算出します。 |
| 13. |
スタンダードおよびサンプルのタンパク濃度を用いて、下記の計算式にて正規化を行います。
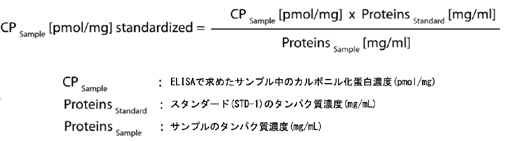 |
|
| 【ご注意】本製品は研究用試薬です。研究以外の用途(臨床検査/診断/医療行為等)には使用できません。 |
日研ザイル株式会社 日本老化制御研究所 〒437-0122 静岡県袋井市春岡710-1 TEL 0538-49-0125 FAX 0538-49-1267
Copyright© 2011 JaICA All Rights Reserved.
| 【ELISA測定操作】 |
| 1. |
分割式マイクロプレートのうち、使用する数だけ取り出します。残りは袋に戻して密閉、冷蔵保存します。 |
| 2. |
誘導体化処理、希釈したサンプル、スタンダード及びコントロールを 200μL/ウェル分注します。
N=2での測定を推奨します。 |
| 3. |
プレートをしっかりシールして、2〜8℃にて3時間または一晩反応させます。 |
| 4. |
ウェル内の液を捨て、希釈済み洗浄液 250μLにて5回洗浄、
最後にペーパータオルに叩き付けて液をよく切ります。 |
| 5. |
全てのウェルに、希釈済み1次抗体試薬を 200μL/ウェル分注、しっかりシールして室温にて20分間静置します。
※振とうしないよう、注意してください※ |
| 6. |
ウェル内の液を捨て、希釈済み洗浄液 250μLにて5回洗浄、
最後にペーパータオルに叩き付けて液をよく切ります。 |
| 7. |
全てのウェルに、コンジュゲート試薬(CONJ)を 200μL/ウェル分注、しっかりシールして室温にて20分間静置します。
※振とうしないよう、注意してください※ |
| 8. |
ウェル内の液を捨て、希釈済み洗浄液 250μLにて5回洗浄、
最後にペーパータオルに叩き付けて液をよく切ります。 |
| 9. |
全てのウェルに、TMB試薬(SUB)を 200μL/ウェル分注、室温暗所にて15〜20分間静置します。
※光が当たると、バックグラウンドが上昇します。必ずアルミホイル等で遮光してください※ |
| 10. |
全てのウェルに、反応停止液(STOP)を 50μL/ウェル分注、軽く振とうします。 |
| 11. |
直ちに450nmにおける吸光度を測定します。副波長には620nmまたは690nmが適しています。
吸光度が高すぎる場合には、測定波長405nm、副波長620nmとして測定してください。 |
| 12. |
検量線をひき、サンプル中のカルボニル化蛋白量(pmol/mg protein)を算出します。 |
| 13. |
スタンダードおよびサンプルのタンパク濃度を用いて、下記の計算式にて正規化を行います。
 |
|
 |
| 【ご注意】本製品は研究用試薬です。研究以外の用途(臨床検査/診断/医療行為等)には使用できません。 |
日研ザイル株式会社 日本老化制御研究所 〒437-0122 静岡県袋井市春岡710-1 TEL 0538-49-0125 FAX 0538-49-1267
Copyright© 2011 JaICA All Rights Reserved.
| 【参考文献】 |
| 1) |
Oxidatively modified proteins in aging and disease. Beal MF.
Free Radic Biol Med. 32(9), p797-803 (2002)
|
| 2) |
Protein oxidation in aging, disease, and oxidative stress. Berlett BS, Stadtman ER.
J Biol Chem 272(33),p20313-20316(1997)
|
| 3) |
Protein carbonyl measurement by a sensitive ELISA method.
Buss H, Chan TP, Sluis KB, Domigan NM, Winterbourn CC. Free Radic Biol Med 23(3),p361-366(1997).
|
| 4) |
Protein oxidation and aging. I. Difficulties in measuring reactive protein carbonyls in
tissues using 2,4-dinitrophenylhydrazine. Cao G, Cutler RG. Arch Biochem Biophys 320(1),p106-114(1995).
|
| 5) |
Protein damage and degradation by oxygen radicals. III. Modification of secondary and tertiary
structure. Davies KJ, Delsignore ME. J Biol Chem 262(20),p9908-9913(1987)
|
| 6) |
Biochemistry and pathology of radical-mediated protein oxidation.
Dean RT, Fu S, Stocker R, Davies MJ. Biochem J 324 (Pt 1),p1-18(1997)
|
| 7) |
Dialysis-induced oxidative stress: biological aspects, clinical consequences, and therapy.
Descamps-Latscha B, Drueke T, Witko-Sarsat V. Semin Dial 14(3),p193-199(2001)
|
| 8) |
Protein damage and inflammation in uraemia and dialysis patients.
Galli F. Nephrol Dial Transplant. 22(5),v20-36(2007)
|
| 9) |
Oxidation of proteins in neonatal lungs.
Gladstone IM Jr, Levine RL. Pediatrics 93(5),p764-768(1994)
|
| 10) |
Oxidatively modified proteins in bronchoalveolar lavage fluid of patients with ARDS and patients
at-risk for ARDS. Lenz AG, Jorens PG, Meyer B, De Backer W, Van Overveld F, Bossaert L, Maier KL.
Eur Respir J 13(1),p169-174(1999)
|
| 11) |
Carbonyl modified proteins in cellular regulation, aging, and disease.
Levine RL. Free Radic Biol Med 32(9),p790-796(2002)
|
| 12) |
Oxidative modification of proteins during aging.
Levine RL, Stadtman ER. Exp Gerontol 36(9),p1495-1502(2001)
|
| 13) |
Endogenous generation of reactive oxidants and electrophiles and their reactions with DNA
and protein. Marnett LJ, Riggins JN, West JD. J Clin Invest 111(5),p583-593(2003)
|
| 14) |
The impact of preoperative micronutrient supplementation in lung surgery. A prospective
randomized trial of oral supplementation of combined alpha-ketoglutaric acid and 5-hydroxymethylfurfural.
Matzi V, Lindenmann J, Muench A, Greilberger J, Juan H, Wintersteiger R, Maier A, Smolle-Juettner FM.
Eur J Cardiothorac Surg 32(5),p776-782(2007)
|
| 15) |
Modification of plasma proteins by cigarette smoke as measured by protein carbonyl formation.
Reznick AZ, Cross CE, Hu ML, Suzuki YJ, Khwaja S, Safadi A, Motchnik PA, Packer L, Halliwell B.
Biochem J 286 (Pt 2),p607-611(1992)
|
| 16) |
Excess brain protein oxidation and enzyme dysfunction in normal aging and in Alzheimer disease.
Smith CD, Carney JM, Starke-Reed PE, Oliver CN, Stadtman ER, Floyd RA, Markesbery WR.
Proc Natl Acad Sci U S A 88(23),p10540-10543(1991)
|
| 17) |
Metal-catalyzed oxidation of proteins. Physiological consequences.
Stadtman ER, Oliver CN. J Biol Chem 266(4),p2005-2008(1991).
|
| 18) |
Protein oxidation and proteolysis during aging and oxidative stress.
Starke-Reed PE, Oliver CN. Arch Biochem Biophys 275(2),p559-567(1989)
|
| 19) |
Damage to DNA by reactive oxygen and nitrogen species: role in inflammatory disease and
progression to cancer. Wiseman H, Halliwell B. Biochem J 313 (Pt 1),p17-29(1996)
|
|
 |
| 【ご注意】本製品は研究用試薬です。研究以外の用途(臨床検査/診断/医療行為等)には使用できません。 |
|